Seguridad y Operaciones de Laboratorio
Cuando se trabaja dentro de un laboratorio, lo principal a tener en cuenta es la seguridad del operador. Debido a esto, se han ido aportando normas, sugerencias y soluciones a diversos problemas, que garanticen la seguridad de operador y le faciliten su trabajo.
Aquí informaremos sobre las medidas de seguridad que debe conocer un químico y algunas de las operaciones básicas a nivel de laboratorio.
1.1 Etiquetas
¿Cómo se leen las etiquetas y qué información aportan?
-
Empresa o fabricante
-
Riesgo Específico (Frases H y P)
-
Riesgo General (Pictogramas)
-
Medidas Preventivas
-
Frase de Riesgo
-
Nombre de la Sustancia

Frases H y P:
Pictogramas:
SGA (Sistema Globalmente Armonizado)

PPT :
Incluye J.T. Beaker y más
NFPA (Diamante de Fuego)

1.2 Material de Laboratorio
A la hora de trabajar en el laboratorio, se debe tener en cuenta qué instrumento se tiene que utilizar para cada operación.
Aquí mostraremos una muestra de los distintos tipos de material volumétrico extraídos del PPT adjunto.

2.0 Operaciones de Laboratorio
2.1 Soluciones
En química, una solución es una mezcla homogénea, es decir, en una única fase, de dos o más sustancias químicas.
Están formadas por un solvente y uno o más solutos.
-
Soluto: Sustancia o sustancias que se encuentran en menor proporción para formar la solución.
-
Solvente: Sustancia de mayor proporción en la solución.
2.2 Concentraciones

En química, la Concentración es la forma de expresar sencillamente la cantidad de soluto (o de una sustancia) que hay en un solución o medio en el que se encuentra.
La cantidad de dicho soluto puede expresarse de diferentes maneras, por lo cual existen varias formas de expresar la concentración.
-
De forma Cualitativa: Tenemos que pueden ser diluidas o concentras
-
De forma Cuantitativa:
Molaridad [M] o [mol/L]
Gramos por Litro [g/L]
Porcentaje masa/masa [%m/m]
Porcentaje masa/volumen [%m/v]
Porcentaje volumen/volumen [%v/v]


2.3 Preparación de Soluciones
Un trabajo muy común en cualquier laboratorio es preparar soluciones.
Pueden calificarse en dos tipos dependiendo de la exactitud (instrumentos) con que se preparen (aproximadas y exactas).
Aproximada: 0,1 mol/L
Exacta: (0,1020 ± 0,0002) mol/L
Independientemente de la exactitud, también hay dos métodos de hacer una solución:
-
Pesada Directa:
-
Calcular la masa del soluto necesaria para la solución que queramos (ya sabiendo Volumen y Concentración):

-
Medir la masa calculada en balanza (si es exacta, en analítica).
-
Transferir la masa a matraz (si es exacta, en aforado).
-
Agregar solvente (agua) a medida que se agita llevando hasta el volumen deseado.
En caso de ser exacta, se deben hacer los cálculos de incertidumbre



2. Dilución:
La dilución es un proceso por el cual se reduce la concentración de un soluto, es decir, reducir la cantidad de soluto en relación a la cantidad de solución. En este se parte de una solución concentrada (solución madre) y se llega a una más diluida.
Trabajando las concentraciones en % (como para los alcoholes) podemos hacer uso de simples reglas de tres; mientras que para [g/L] o [M] tenemos la posibilidad de utilizar la siguiente ecuación:

Por tanto el proceso de dilución es:
-
Calcular el Volumen inicial (toma)


-
Tomar dicho volumen con material volumétrico adecuado, dependiendo de la exactitud y la cantidad. Una pipeta o probeta, por ejemplo.
-
Colocarlo en un matraz o probeta.
-
Agregar solvente (agua, generalmente) hasta el Volumen final.
2.4 Titulación Ácido - Base
Las Valoraciones, en química, son un método práctico en el cual se mide la concentración de una sustancia (en un determinado medio) mediante una reacción con el soluto de una solución de concentración conocida (Solución Patrón).
Un caso típico y muy fácil de comprender es el que se da en las reacciones Ácido-Base:
Supongamos que se quiere saber cuán ácido es un vino, es decir, su acidez. Para ello, se presume al vino (analito) como si fuese una solución de un determinado Ácido (HCl, por ejemplo) y se le hace una titulación con una Base (NaOH, por ejemplo) de la cual conocemos su concentración exacta (valorante).
Procedimiento:
-
Cálculos:
-
Se plantea la reacción estequiométrica
-
Se plantea la relación entre los moles del ácido y la base

-
Aplicamos la definición de Molaridad
-
Suponemos una concentración aproximada para el ácido, lo más cerca de la que creemos que es (sacada de Bromatología en caso del vino) y ponemos un valor de toma, es deicr, cuánto volumen de vino vamos a valorar.
Teniendo eso, calculamos el VNaOH, es decir, el gasto de la bureta.

2. Experimental:
-
Se hace una toma del vino con pipeta y se vierte en un vaso de bohemia.
-
Se pone un reactivo indicador, como la Fenolftaleina (dependiendo del punto de equivalencia).
-
Se llena la bureta hasta el aforo con el NaOH.
-
Y finalmente se arma el sistema mostrado en la imagen.
*Por conveniencia práctica puede sustituirse el vaso por un matraz y agitar manualmente*
Ejemplo de ejercicios de Valoración:
2.5 Patrones Primarios
Un patrón primario es una sustancia, generalmente sólida, con la que se pueden preparar Solución Patrón (o Solución Estándar) con las cuales se pueden realizar valoraciones.
Para decir que una sustancia es un Patrón Primario, debemos asegurarnos que cumpla con las siguientes normas:
-
Pureza elevada
-
Estructura conocida
-
Estables a condiciones de trabajo (Temperatura y Presión)
-
Gran Masa Molar
-
Debe resistir temperaturas de secado (100ºC - 110ºC)
-
No debe ser higroscópico
-
Reaccionar rápida y estequimétricamente con el analito
Para valorar Bases:


Para valorar Ácidos:

2.6 Humedad y Secado (de sólidos)
Humedad:
Cantidad de agua disuelta en un gas o absorbida por un sólido.
Tipos de Secado:
-
Secado en Estufa
-
Secado por Radiación Infrarroja
-
Secado en Balanza Térmica
Procedimiento de Secado en Estufa:
-
Masar al sólido
-
Llevar a Estufa con T > 100ºC
-
Volver a masar
-
Llevar a Estufa nuevamente
-
Repetir hasta Constancia de masa
¿Por qué es importante medir el porcentaje de Humedad (%h)?
-
Evita el crecimiento de microorganismos (muy importante en comestibles).
-
Evita el agregado de H2O en productos comerciales (para no pagar por agua en productos químicos, por ejemplo,).
-
Uso de Patrones Primarios
Calcular la humedad en un sólido
Cuando termina el secado, y se obtiene la Constancia de masa, llegamos a una masa final del sólido (mfinal) que no contiene agua.
Por lo tanto, la diferencia que hay entre la masa inicial del sólido (minicial) y esta masa final (mfinal), es la masa del H2O eliminado (mH2O).


Agentes de Secado:
Son sustancias que se utilizan para secar solventes orgánicos y gases.
No Reversibles: Reaccionan con H2O dando nuevos compuestos (Na, P2O5, CaO).
Reversibles: Son sales anhidras que forman hidratos (Na2SO4, MgSO4, CaCl2).
2.7 Tipos de Agua en Sólidos
1. Esencial:
Agua de Contribución:
Es el H2O que se forma por la descomposición del sólido.
Agua de Cristalización:
Es el H2O que se encuentra ayudando a la estructura cristalina del sólido.
Ejemplo: CuSO4·5H2O
2. No Esencial:
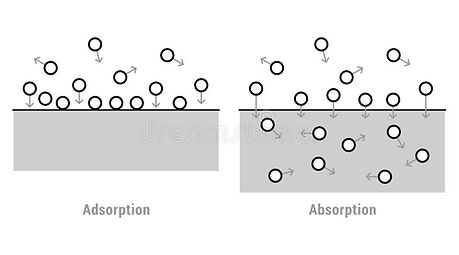
Agua de Higroscopicidad:
Agua adsorbida, en la superficie del sólido.
Ejemplo: En silica gel (gel de sílice).
Agua Ocluida:
El agua está retenida en cavidades de sólidos.
Ejemplo: En sólidos obtenidos por cristalización.
Agua de imbibición:
Agua absorbida, en general produce hinchamiento del sólido.
Ejemplo: Agar o papel (celulosa).
2.8 Cristalización
Supongamos que necesitamos valorar un ácido, pero el laboratorio quiso abaratar costos y compró un Na2CO3 de baja calidad, por lo que no puede usarse como Patrón Primario, ya que una característica que debe cumplir es Pureza Elevada.
¿Cómo se resolvería?
Lo que deberíamos hacer es purificarlo, es decir, elevar su pureza. Para ello, una de las operaciones más eficientes es la Cristalización.
-
La Cristalización es un proceso físico que se da cuando las partículas (moléculas, átomos, iones) de un sólido se encuentran ordenadas en una disposición que se repite periódicamente en todo el sistema y en las 3 dimensiones, es decir, se da cuando forman un cristal.
Este método es eficaz para aumentar la pureza porque el orden geométrico y espacial específico de las partículas en un cristal no permite la intervención de sustancias que hayan quedado disueltas en el medio.
A este patrón que se repite se le llama Celda Unidad (o Unitaria) y al sistema formado se le llama Red Cristalina o Estructura Cristalina.

Tipos de Cristalización en solución:
1. Cambio de Solvente:
Para hacer uso de esta técnica se debe tener al soluto en un solvente donde sea muy soluble. Teniendo esto, se agrega un segundo solvente, que sea miscible con el anterior y en el cual nuestro soluto sea insoluble o presente una solubilidad considerablemente inferior.
Ejemplo: A 20ºC, el NaCl presenta una solubilidad en agua de 6 M (cerca de 36g cada 100mL de agua) y en Etanol presenta una solubilidad de 0,009 M (algo así como 0,5g cada 100mL de Etanol).
2. Evaporación de Solvente:
Si tenemos un soluto en una solución, su concentración puede aumentarse añadiendo más soluto o retirando solvente (llevándolo a Punto de Ebullición).
Sabiendo eso, se puede eliminar solvente hasta que obtengamos un exceso del soluto, es decir, que haya una solución hasta el tope de su capacidad de admitir soluto y un sólido (cristal) que decanta.
Ejemplo: Retomando el caso anterior, supongamos que tenemos 300mL de una solución saturada NaCl a 20ºC.
Aplicando una sencilla regla de 3 sabemos que hay aproximadamente 108g, de la sal, disueltos.

Si calentamos la solución hasta que el volumen llegue a 100mL (y dejamos que el sistema vuelva a 20ºC), podemos aplicar la misma regla y saber que habrá:
-
100mL de solución saturada de NaCl 6M (36g disueltos)
-
Sólido cristalizado al fondo del vaso (72g)
3. Cambio de Temperatura:
La Solubilidad expresa la cantidad de soluto que puede disolver un cierto solvente a una Temperatura determinada.
Como dice su definición, su valora cambia dependiendo de la Temperatura, generalmente aumenta junto a ella en sólidos, por lo tanto, si el soluto presenta un gran cambio al variarla, podemos utilizarlo para cristalizar.
Ejemplo: Si tenemos Nitrato de Potasio impuro y queremos purificarlo, este tiene un gran cambio de solubilidad en agua cuando se aumenta la Temperatura como se muestra en el gráfico.
.jpg)
Procedimiento:
-
Se busca solvente en el cual el soluto presente variación de Solubilidad
-
Preparar solución sataurada en caliente
*Filtrar si hay impurezas insolubles (obteniendo Solución+impurezas solubles)* -
Enfriar hasta donde la Solubilidad es menor
-
Filtrar por succión (obteniendo Cristales húmedos)
-
Lavar los cristales con solvente frío (para eliminar impurezas disueltas en el solvente)
-
Secar cristales (obteniendo cristales puros)
2.9 Filtraciones
Tras la cristalización de la sustancia, siempre se obtienen 2 fases:
-
Los cristales
-
Solvente que tiene impurezas disueltas y parte del soluto
De modo que para separar los cristales del resto, se hace una filtración.
La filtración es un método práctico de separación de fases, mediante un medio poroso (filtro), para un sistema que tiene al menos una fase sólida y otra con un fluido.
Tipos de Filtro:
-
Papel
-
Algodón
-
Plástico
-
Lana de Vidrio
-
Tierras de Diatomeas

2.10 Métodos de Extracción
Una extracción consiste en transferir una sustancia, desde una fase inicial (matriz) hasta una fase final (agente de extracción, AE).
A la hora de buscar un AE, es necesario saber que este debe ser inmiscible con la matriz y en lo posible el analito debe ser más soluble que en la matriz.
-
En una extracción nunca se llega a extraer un 100% del analito, ya que siempre se establece un equilibrio entre las cantidades disueltas en la matriz y en el agente de extracción.
-
Es más eficiente añadir pequeñas cantidades del AE varias veces, que añadir un gran volumen de una sola vez.
Tipos de Extracción:
-
Líquido-Líquido
-
Sólido-Líquido (Soxhlet y Clevenger)

1. Extracción Líquido-Líquido:
Para hacer uso de esta técnica se debe tener al analito en una matriz líquida. Teniendo esto, se agrega un segundo solvente, que sea inmiscible con el anterior y en el cual nuestro analito sea más soluble.
Etapas de Extracción:
La extracción Embudo de Decantación se fundamenta en las siguientes etapas:
-
Se tiene a la sustancia a extraer en una fase líquida.
-
Se coloca dicha matriz en el Embudo de Decantación asegurándose que la llave esté cerrada.
-
Se agrega el nuevo solvente, es decir, el agente de extracción (al ser inmiscibles, aparecen 2 fases).
-
Se tapa el sistema, habiendo puesto vaselina en el esmerilado.
-
Finalmente se inclina el sistema y agita el embudo, sosteniendo la tapa, con una mano, y la parte inferior, con la otra.
-
Luego se unos minutos agitando, se abre la llave, manteniendo la inclinación, para dejar salir posible gas.
-
Se repiten los últimos 2 pasos algunas veces y se vierte el agente de extracción a un recipiente.
-
Repetir desde el paso Nº3 con nuevo solvente.

PDF explicando los Métodos de Extracción:
2. Extracción Sólido-Líquido:
Para hacer uso de esta técnica se debe tener al analito en una matriz sólida. Teniendo esto, se agrega un solvente (en el cual nuestro analito sea soluble) el cual entrará en contacto con la muestra para disolverla y arrastrarla. El equipo más usados es el Soxhlet.
Etapas de extracción con Soxhlet:
-
Poner muestra sólida en el Cartucho y su tapón correspondiente.
-
Colocación del solvente en un balón y armar el sistema de la figura.
-
Calentar el solvente hasta su PE. Para que se evapore subiendo hasta un condensador a reflujo.
-
El condensado cae en el cartucho poroso con la muestra en su interior.
-
Sube el nivel del solvente cubriendo el cartucho hasta un punto en que se produce un efecto sifón llevando solvente y analito al balón.
-
Se vuelve a producir este proceso la cantidad de veces necesaria para que la muestra quede agotada.
*Lo extraído se va concentrando en el balón del solvente*